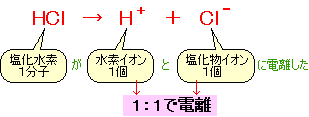
塩化 水素 電離
塩酸の電気分解について演習問題を行います。電離のようすから、各電極で発生する物質まで、しっかりと確認しましょう。塩酸の電気分解の確認問題 塩酸の溶質は何か。 塩酸は混合物か化合物か。 気体の塩化水素が水に溶けて電離するようすを、化学式.

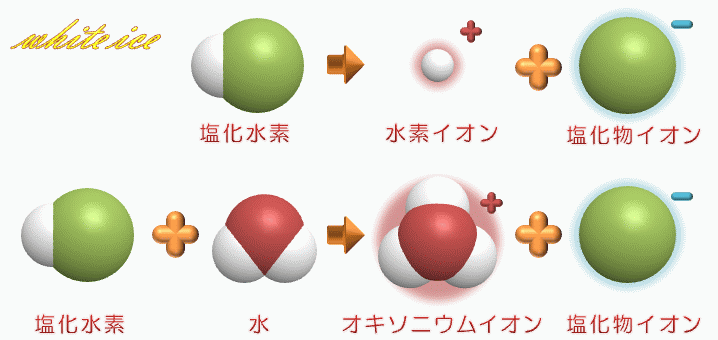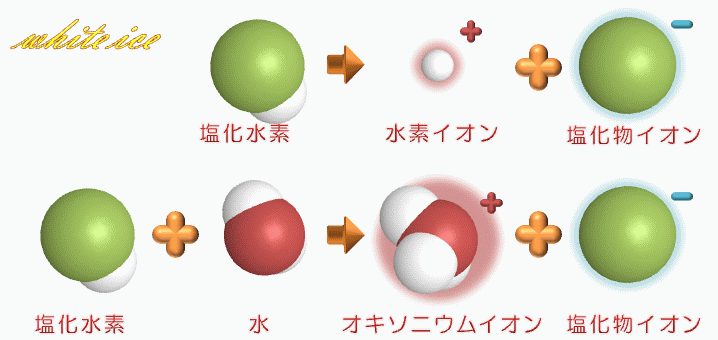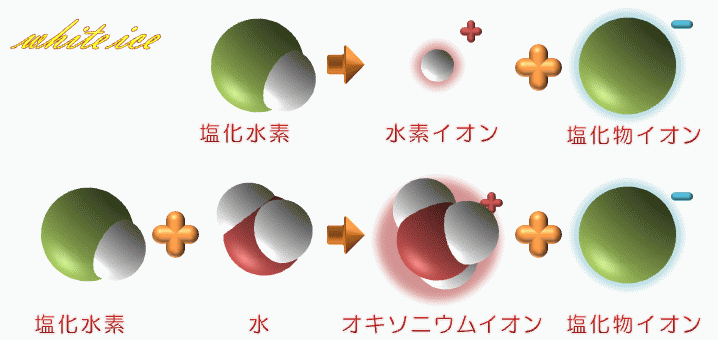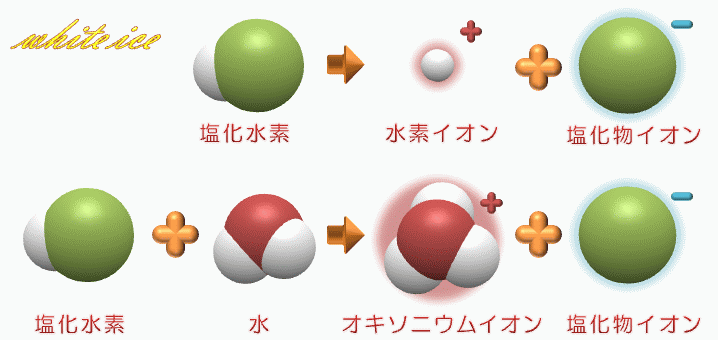
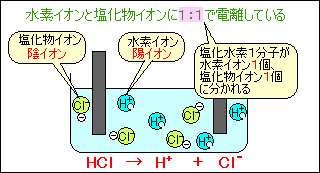
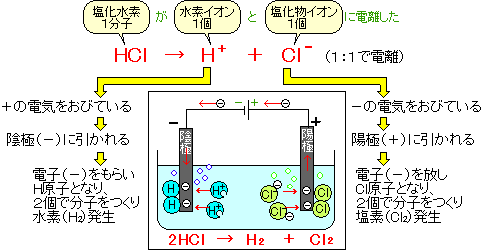
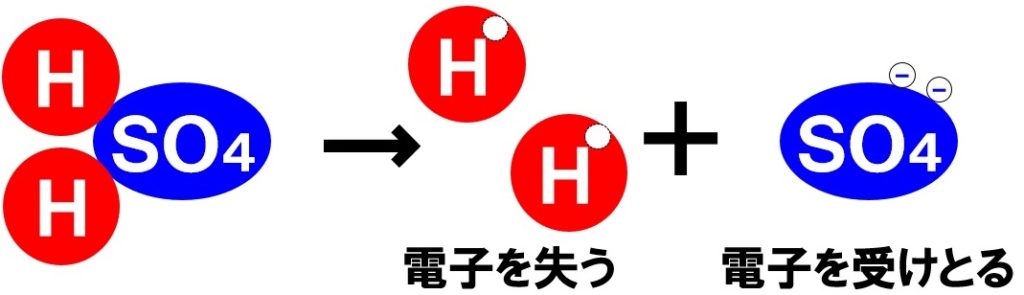
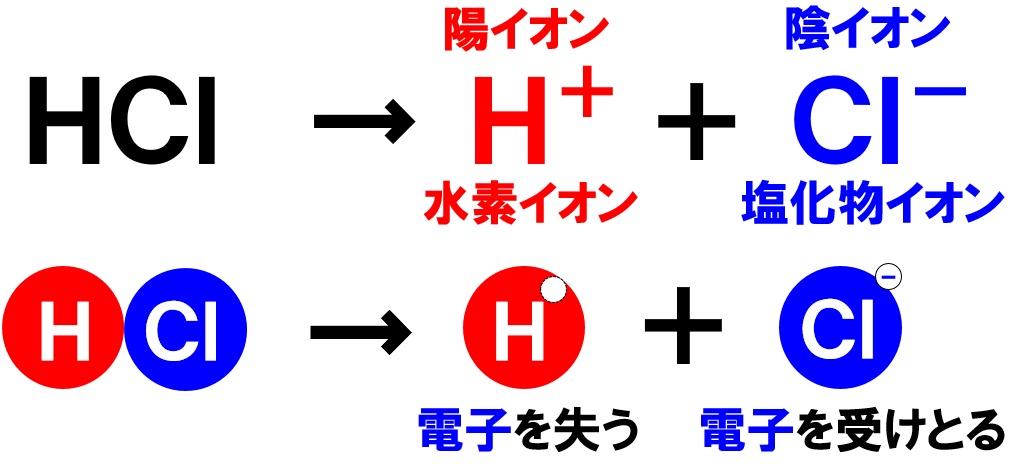
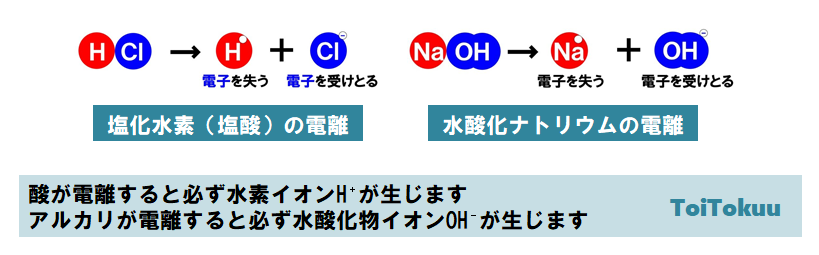
塩化 水素 電離. 塩化カリウムの沈殿が生じる。 理由 : 塩化水素から電離した塩化物イオンの共通. 2HCl → H 2 + Cl 2. 電解質である気体の塩化水素を水に溶かすと、陽イオンと陰イオンに電離します。 塩化水素の化学式はHClでしたね。 化学式の前に書いてある水素 H が電子を失い 陽イオン である水素イオン H⁺ に、後に書いてある塩素 Cl が電子を受けとり、 陰イオン である塩化物イオン Cl.
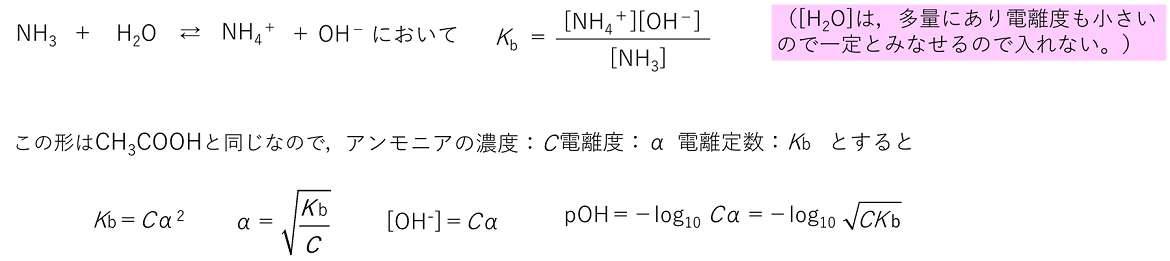
〈電離①〉 (C)13 Prisola International Inc. イオン効果により、塩化カリウムの溶解平衡が析出 する方向に移動するため。 硝酸カリウム飽和溶液 何も変化しない。 理由 : 塩化水素には硝酸イオンもカリウムイオン. のように完全に電離しています。 一方で水もわずかに電離して \( \mathrm{H_2O \rightleftharpoons H^++OH^-}\) の平衡状態になっています。 この2つが混じり合った状態なので弱酸である酢酸は電離度が小さく、酢酸イオンが水素イオンと結合し酢酸分子にもどります。.
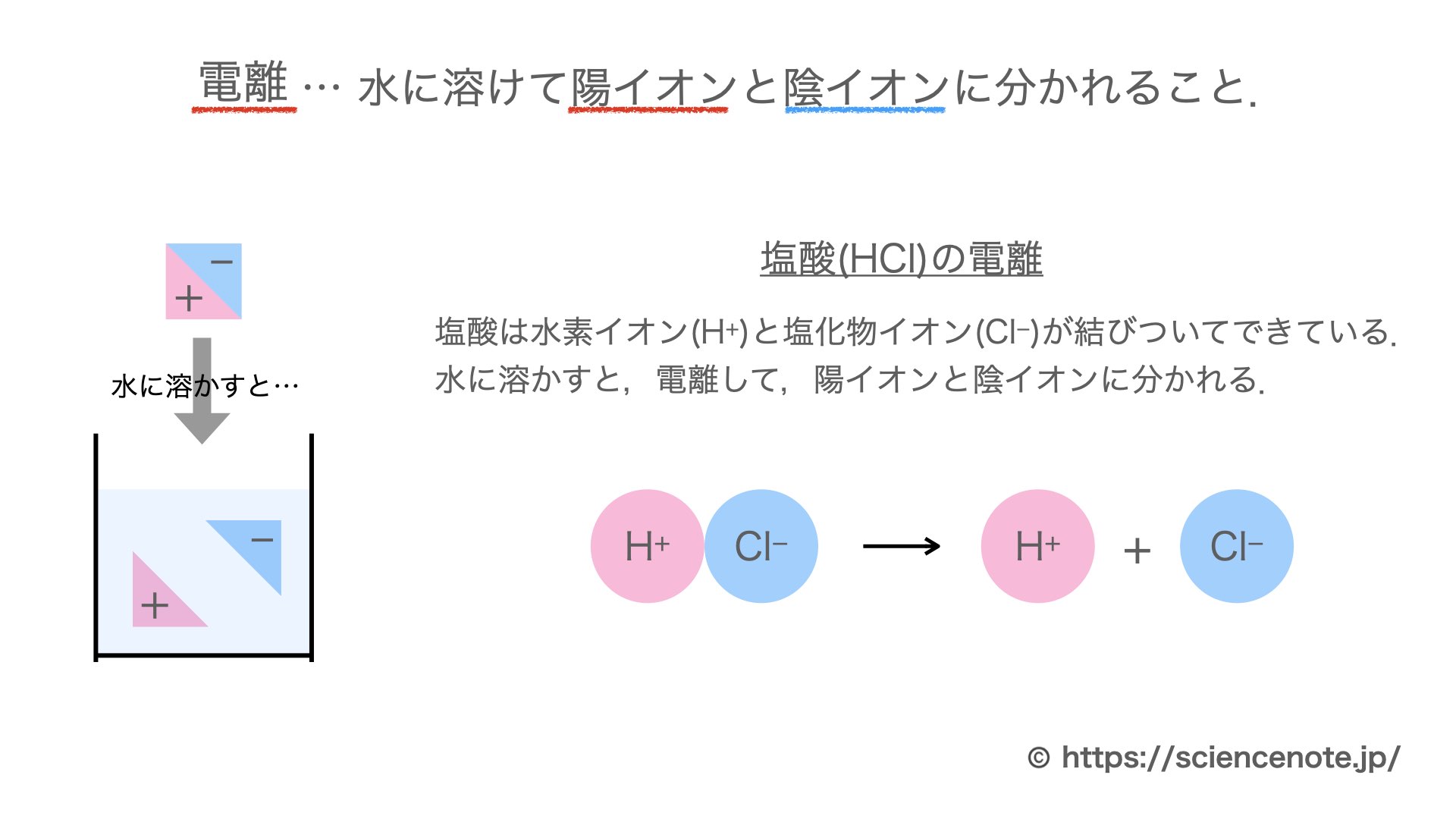
・塩化ナトリウムと塩化水素の電離についての説明 を聞き,電離のようすを,イオン式を使って表す。 ・非電解質に電流が流れない理由を考え,発表する。 〜22 ・砂糖水を例に,非電解質の水溶 液には電流が流れない理由を説 明できる。. 塩化水素は極性分子です。F、O、Cl、N原子などはとくに電子を引きつける性質があります。これらの原子と水素が共有結合で結合した分子は、水に溶けたときに水素が水素イオン H + となって電離しやすいのです。. 2 電離・・・電解質が水にとけて、陽イオンと陰イオンに分かれること。 塩化水素HClの分子は、 水にとけると電離して 水素イオンH+と塩化物 イオンCl-に分かれる。 塩化水素 塩化水素→水素イオン+塩化物イオン.
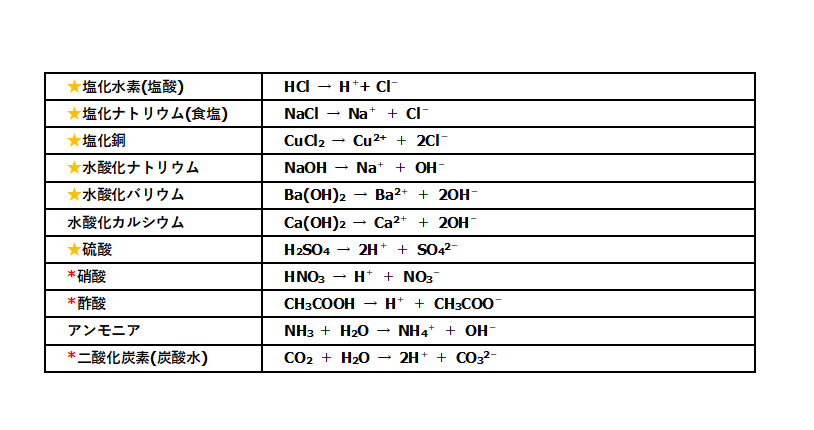
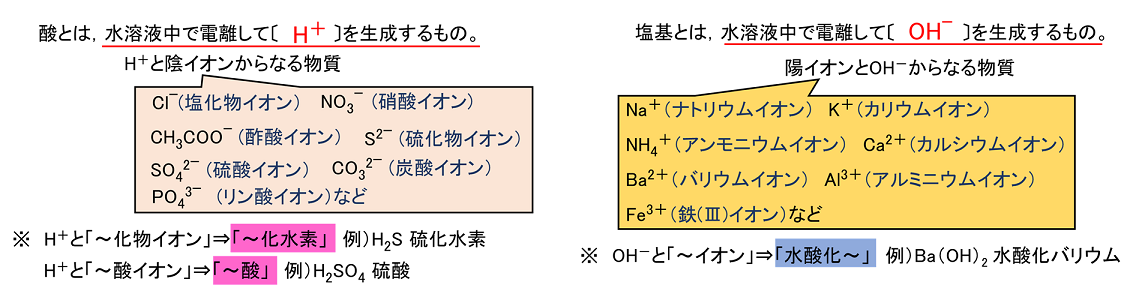
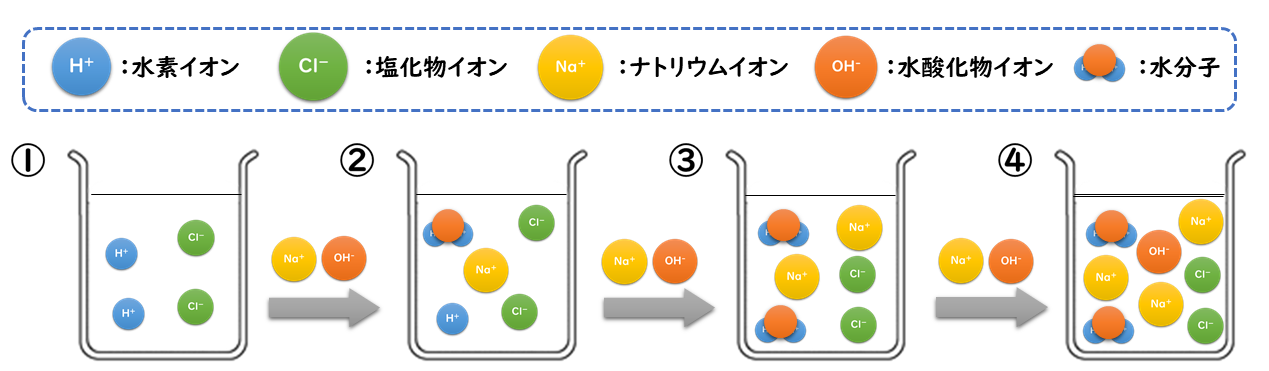
したがって、(プラスとマイナスは引き合うので)電離の結果できたNa + とCl – の周りには、それぞれ水分子のδ-のところとδ+のところが近づいてくる。. 電離式は「化学式 → 陽イオン+陰イオン」が基本形となります。ただしアンモニア、二酸化炭素は「化学式+水分子 → 陽イオン+陰イオン」の形で表します。塩化水素、塩化ナトリウム、水酸化ナトリウム、塩化銅の電離式は特に重要です。. 電離しない。例ショ糖,エタノール 化学電池…化学エネルギーを電気エネルギーに変えるしくみ。電解質の水溶液に2種類 の金属を入れると,化学電池になる。 水溶液とイオン 酸…電離して水素イオンを生じる物質。 アルカリ…電離して水酸化物イオンを.
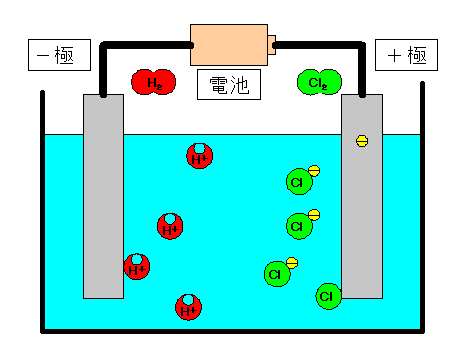
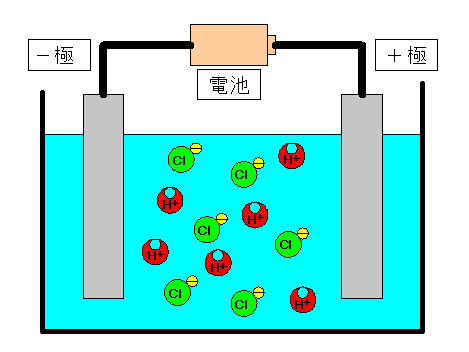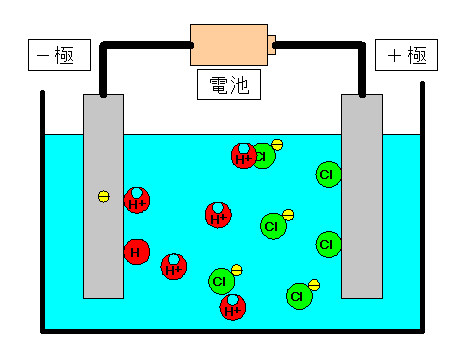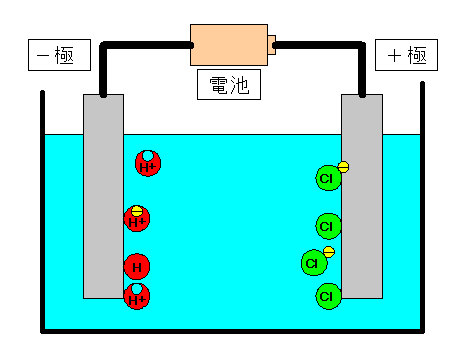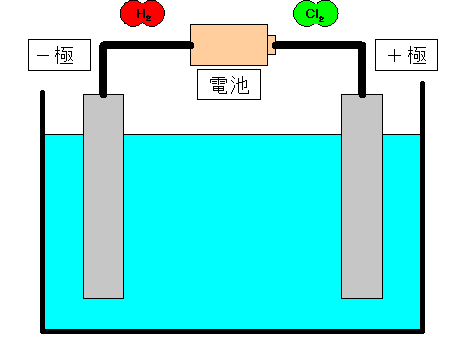
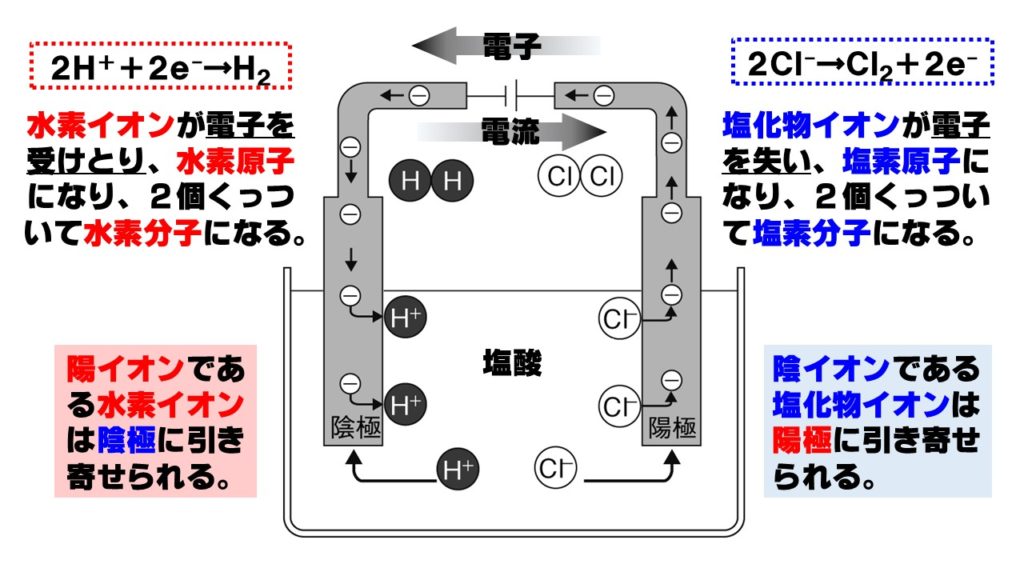
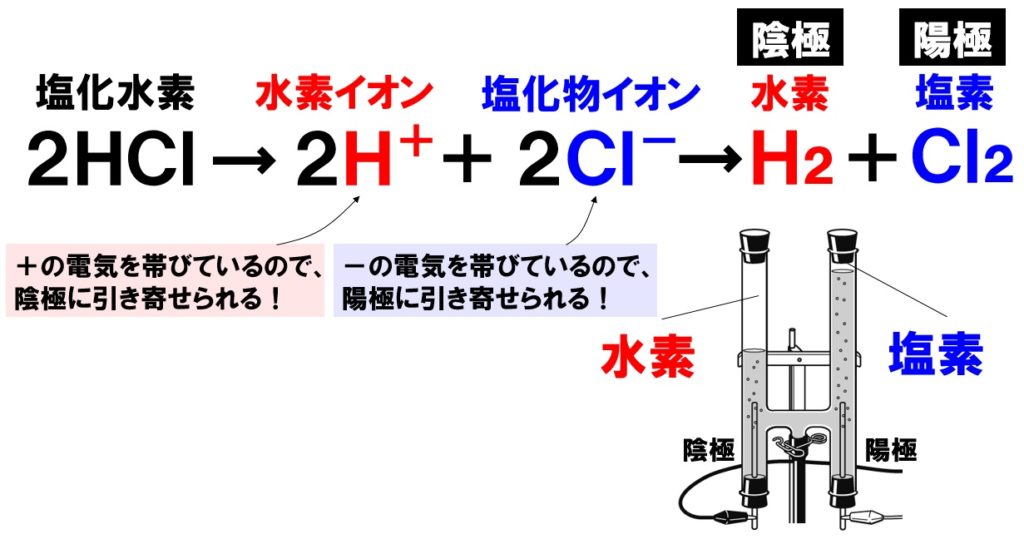
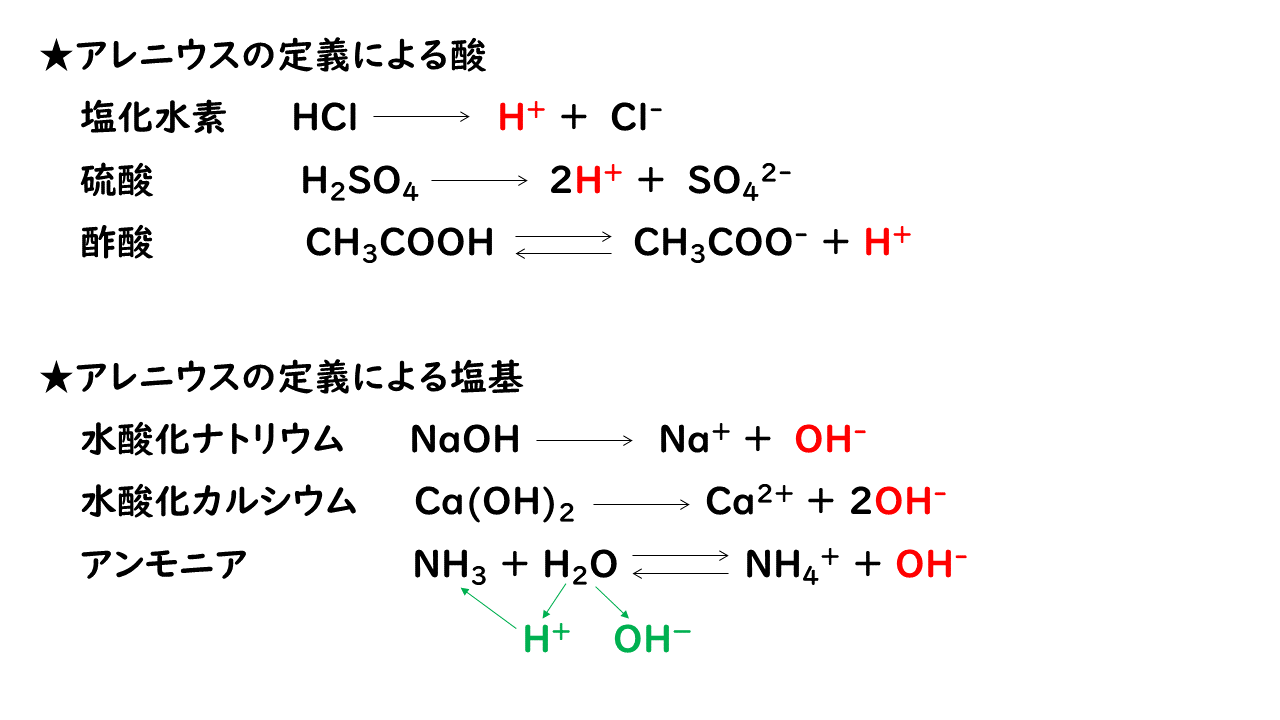
電離式:HCl→H + +Cl - 陽極:塩化物イオン(Cl - )が引きつけられる→電子(e - )を1個渡して塩素原子(Cl)に→塩素分子(Cl 2 )になり塩素が発生する(2Cl - →Cl 2 +2e - ) 陰極:水素イオン(H + )が引きつけられる→電子(e - )を1個受け取って水素原子(H)に→水素分子(H 2 )に. 塩化ナトリウム→ ナトリウムイオン + 塩化物イオン NaCl → Na⁺ + Cl⁻ 化学式の前にあるNaが陽イオン、後のClが陰イオンになります。 塩化水素(塩酸)の電離. ?.アレーニウスの酸・塩基 水素原子を持ち、水溶液中で電離して水素イオンH+を生じる物質を酸といい、水酸基OHを持ち、水溶液中で電離して水酸化物イオンOH−を出す物質を塩基という。この定義はアレーニウスの電離説にもとづくものである。 塩酸は塩化水素HClの水溶液であるが、次の.
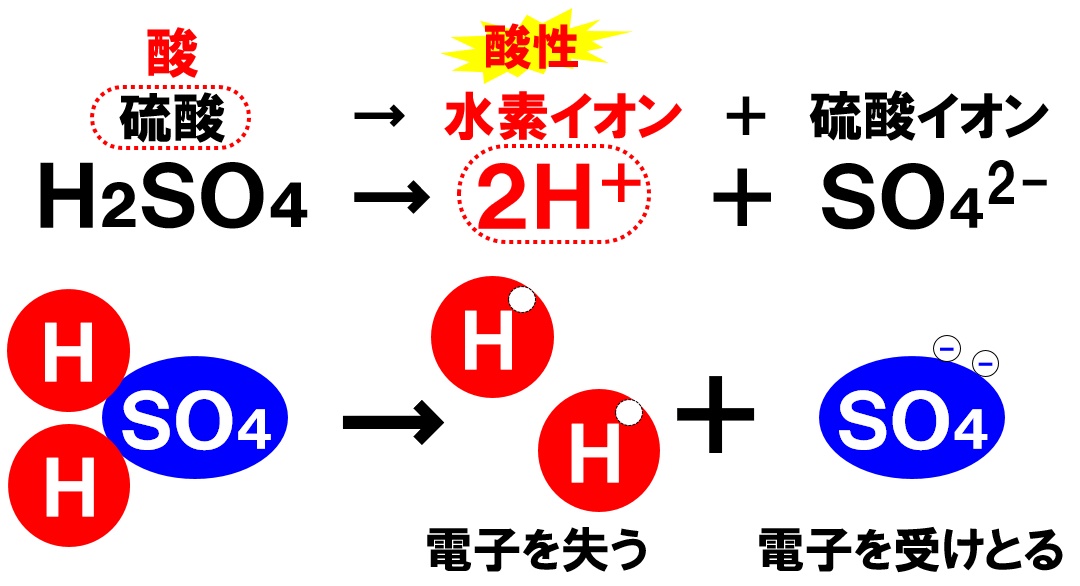
塩化水素を水にとかすと塩酸という水溶液になります。塩酸の中でのイオンの電離のようすを考えてみます。 塩化水素の化学式は hcl だから、電離の式は. 第 3 節 電離平衡. 酸・塩基の価数 塩化水素HClや硫酸H 2 SO 4 を水に溶かすと,次のように電離して水素イオンH + を生じます。 HCl → H + + Cl - H 2 SO 4 → 2H + + SO 4 2- このとき,化学反応式と量的関係を考えると,1molの塩化水素HClが電離すると1molの水素イオンH + が生じます。.
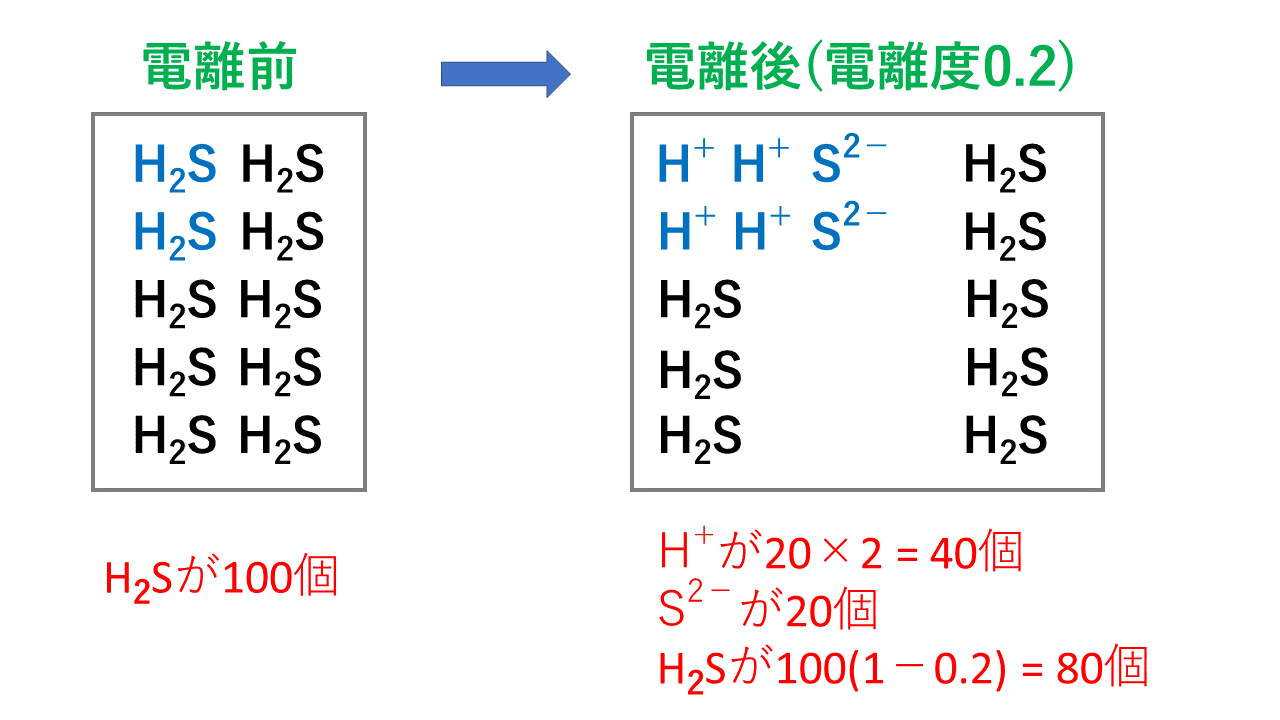
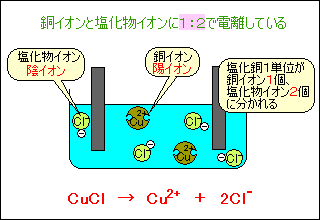
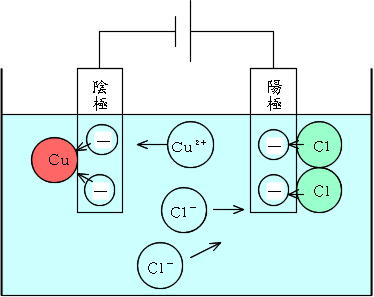
つまり、個電離します。 電離度0.2ということは、電離しない割合は1-0.2 = 0.8なので、80個(100×0.8)が電離せず h 2 sのまま残ります。. イオン式まとめイオン式とは「〇〇イオン(水素イオンや塩化物イオンなど)」をアルファベットで表したものです。※元となっているのは元素記号(原子記号)です。※→イオンとは← / →原子と分子← / →元素記号・化学式まとめ←も参考に. 塩化水素→水素+塩素 2HCl → H 2 + Cl 2 ※水素と塩素は発生する体積は同じだが、 塩素は水に溶けやすいので 集まる 体積は塩素が少ない。 塩化銅水溶液 電離式CuCl 2 → Cu 2+ + 2Cl − 銅イオン(Cu 2+) 陽イオン(+)なので陰極(−)に引きつけられて移動する。.
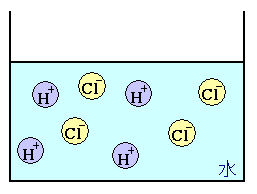
塩化水素 → 水素 + 塩素. 塩化物イオンは水素を押し付ける相手がいません。 さらに溶液が加熱されているため、 塩化水素は耐えられずに揮発してしまいます。 揮発が進むことで平衡が傾き、 次々と塩化水素が作られていくのです。 以上のように、 弱酸の遊離反応と加熱の. 塩化水素は常温常圧下では気体であり、塩化水素の水溶液を塩酸と呼ぶ。 気体の塩化水素は、塩化水素分子として存在し、水溶液である塩酸中では、塩化水素はほぼ完全に正負のイオンに電離している。 + + + − 常温常圧下で、濃度がほぼ25%以上の塩酸には発煙性がある。.
塩化水素は常温常圧下では気体であり、塩化水素の水溶液を塩酸と呼ぶ。 気体の塩化水素は、塩化水素分子として存在し、水溶液である塩酸中では、塩化水素はほぼ完全に正負のイオンに電離している。 + + + − 常温常圧下で、濃度がほぼ25%以上の塩酸には発煙性がある。. ブリタニカ国際大百科事典 小項目事典 - 電離の用語解説 - 電解質溶液ではその溶液内に未解離の分子と,解離して生じたイオンとが存在し,両者の間には平衡状態が成立している。このようにイオンに解離する現象を電離という。 17年,s.アレニウスによって電離説として提唱された。. 7.電離のようすを式で書きなさい。(予習 3年理科の教科書P22~P25 参照) 例 塩化ナトリウムの電離 +NaCl -→ Na + Cl (1)塩化水素の電離 (2)水酸化ナトリウムの電離.
塩化水素の化学式 から、電離したとき のイオン式を、関心 をもって考えよう としている。 ⑤電解質の水溶液に電 流が流れる理由をイ オンと関連付けて説 明している。 ⑥砂糖水を例に、非電 解質の水溶液には電 流が流れない理由を 説明している。 ⑤. 塩化水素の電離式は、HCl→H++Cl-では、塩酸の電離式を書けと言われたら、塩化水素の電離式を書けば良いのでしょうか? でも、それでは水が含まれてないから、HCl+H2O→H++Cl-+H++OH-ということになりますか??中3レベルで教えて下さい!! 塩酸の電離式を書けこの問題文に対して、中三のあなた. Learn vocabulary, terms, and more with flashcards, games, and other study tools.
塩化水素の電離のようすを化学式とイオン式で答えなさいという問題で、HCl→H++Cl-になるじゃないですか? 最初のHClが2HClにならないのはなぜですか? 塩化水素の電気分解の実験だと化学反応式は2HCl→H2+Cl2ですよね。 だから塩化水素は2HClだと思っちゃってて…. 中3 理科 中3-4 塩化銅水溶液の分解 ・ イオンver. 塩化水素の気体はアンモニアの気体と反応しますので酸です。 HCl + NH3 → NH4Cl この反応はHClはH+を放出し、それをNH3が受け取って NH4+になることによりおこります。 また、塩酸は水中で塩化水素が電離しています。.
塩化水素 HCl を水に溶かすと、塩化水素HClを構成する原子のうち、水素原子 H は 電子を1つ失って 水素イオン H⁺ 、もう一方の塩素原子 Cl は、 電子を1つ受けとって 塩化物イオン Cl⁻ になります。 塩化銅の電離. トップ > 化学 ii > 第 2 部 反応速度と平衡>第 2 章 化学平衡> 第 3 節 電離平衡. 例えば、硫化水素 h 2 sの電離度が0.2で、100個あったとすると、.
例えば、塩化水素 HCl は強い酸ですが、その共役塩基 Cl-は弱い塩基です。すなわち、共役塩基 Cl-は H + に対して、非常に弱い親和性しか持っていないということです。それ故に、塩化水素 HCl が電離. 塩化水素(HCl)は、水に溶かすと陽イオンである水素イオン(H + )と陰イオンである塩化物イオン(Cl-)に電離します。 電解質の例 水に溶けて酸性や塩基性を示す 酸 や 塩基 が該当します。. さっそく電離式の一覧を下に載せますが、 その下にはさらに、 電離の解説 や、 電離式の練習問題 があるので、ぜひ勉強に活用してください!.

電離するかどうかの判断を教えて下さい Clear
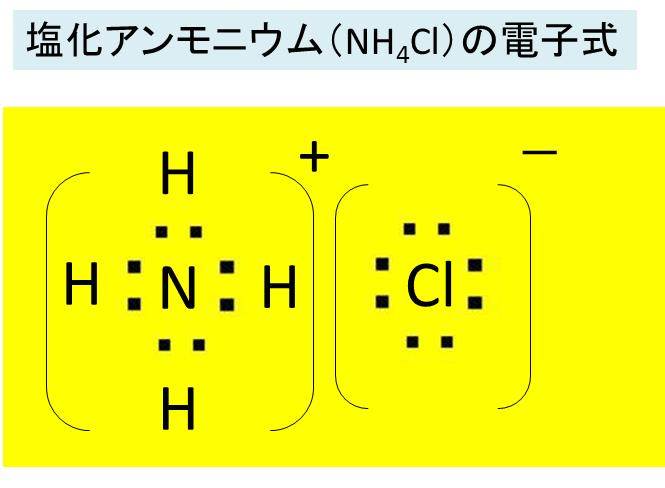
塩化アンモンニウム Nh4cl の化学式 分子式 構造式 電子式 電離式 分子量は 塩素とアンモニアの混合で白煙を生じる反応式
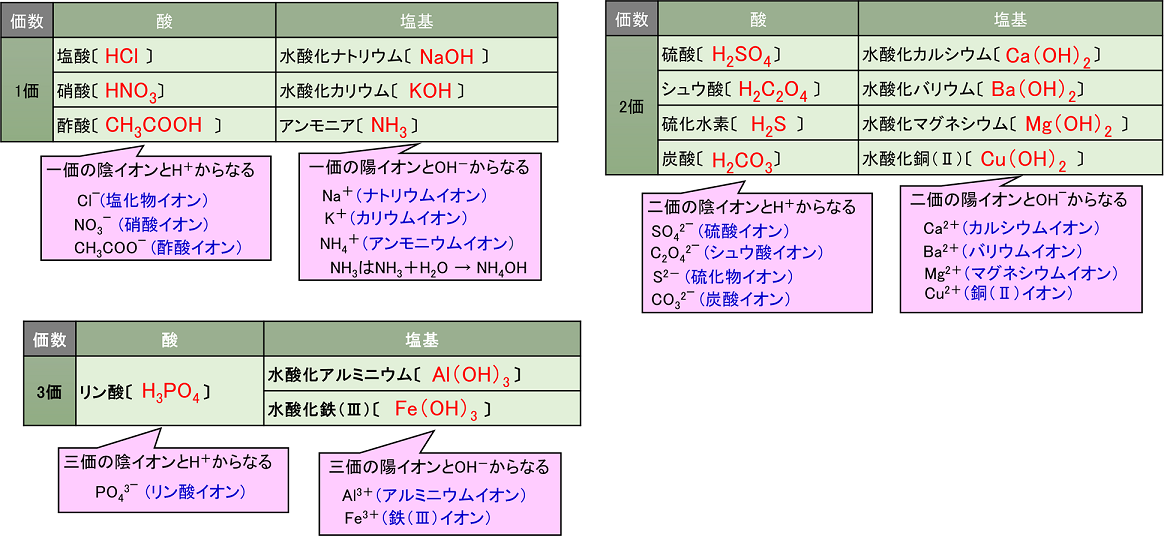
酸と塩基
塩化 水素 電離 のギャラリー
Http Www Iwamizawanougyou Hokkaido C Ed Jp Kadai 1nenkadaikyouka Rika Rika Pdf
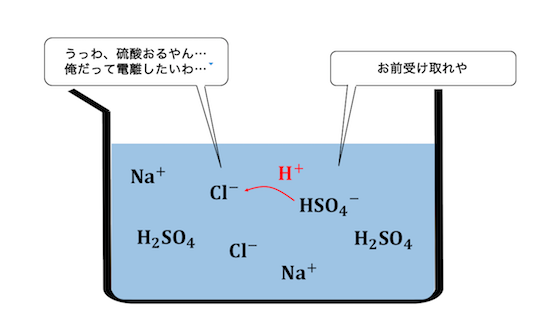
揮発性の酸遊離反応 受験メモ

化学の電離度の範囲で解説がなくわからないので質問させて頂きました 化学 教えて Goo
Q Tbn 3aand9gcs74y3aowi3xvllzzclofytsgqsumqsqijv7 Urhohkdzrf 7xi Usqp Cau

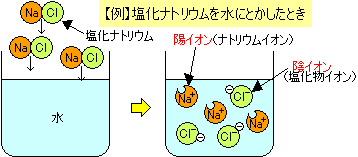
Nacl 塩化ナトリウム と砂糖が水に溶ける理由
Http Www Iwamizawanougyou Hokkaido C Ed Jp Kadai 1nenkadaikyouka Rika Rika Pdf
Http Tokyogakkan Lekumo Biz Todays Gakkan Files 2tokuri Kagaku 0417 Pdf

どうして塩化水素 Hcl の塩化はclなのに 塩化銅 Cucl2 の塩化はcl2なの Clear
Q Tbn 3aand9gcqp1nnll65d3yqpt6xmdgaxkebilabp9 Zwgbcn1ojjjvujizvn Usqp Cau

中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス
3年理科の質問 電離と反応式で塩化水素の記号が違うのは Yahoo 知恵袋

電離とは何か 電離度と電離定数を使って理解しよう 高校生向け受験応援メディア 受験のミカタ

現在 とある資格取得の為 独学で化学を勉強しています 学生時 化学に関する質問 勉強質問サイト

Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ

硫酸 硝酸と来てなぜ塩酸とならないのでしょうか 塩化水素は気体ですよね Clear
化学 5分でわかる 電離度の意味と強酸 強塩基 弱酸 弱塩基と一覧 Vicolla Magazine
塩酸の電気分解について 理科の部屋 学習教材の部屋

高校化学 塩化アンモニウムの加水分解 映像授業のtry It トライイット

Nacl 塩化ナトリウム と砂糖が水に溶ける理由

硫酸の電離式は付箋の下の式だと間違っていますか 教科書だと上の式で載っていました Clear

中3の理科の電離の式の問題で 数合わせのために水素イオンが2h とか 化学 教えて Goo

6 です 赤い文字が解答です Clear
Web教材イラスト図版工房 理 16 福岡 K 04 01
酸と塩基 電離平衡
中学理科 中和反応とイオンの量の変化 なるほどの素
塩化銅の電解
Q Tbn 3aand9gcscyx7qomyayf3 Cchr Bsqzmbhc7ver64dxq Usqp Cau
Q Tbn 3aand9gcqp1nnll65d3yqpt6xmdgaxkebilabp9 Zwgbcn1ojjjvujizvn Usqp Cau

中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理

電離と電離度 化学に関する質問 勉強質問サイト
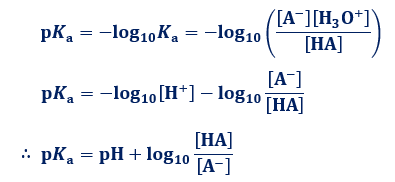
酸と塩基 電離平衡
塩酸の電解

電離式の一覧 中学生用

Title

中学理科 水溶液とイオン 電気分解 基礎 教科の学習
Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Volatile Acid

中3化学 電離 電解質 中学理科 ポイントまとめと整理
Science イオン 働きアリ The 2nd
中3化学 電離 電解質 中学理科 ポイントまとめと整理

電離と電離度 化学に関する質問 勉強質問サイト
Q Tbn 3aand9gcsm8xr0roawkny4 6hicexvmuhet6dn7o6ula Usqp Cau

水溶液の性質まとめ 中学理科 ポイントまとめと整理
中3理科 塩酸の電気分解のポイント Examee

センター試験対策 硫酸に関する問題 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc

高校無機化学 ハロゲン 17族 の化合物 フッ化水素 塩化水素 次亜塩素酸 の製法と性質まとめ 受験の月

高校無機化学 揮発性酸の遊離反応 受験の月
酸と塩基
Q Tbn 3aand9gcqp1nnll65d3yqpt6xmdgaxkebilabp9 Zwgbcn1ojjjvujizvn Usqp Cau

電離についてふと気になったんですが なぜnaclなどの電解質を水に溶かすと電離するん Clear
2 水素イオン濃度 水酸化物イオン濃度塩化水素hclは 水溶 Yahoo 知恵袋

Web教材イラスト図版工房 R C1m 塩化水素の電離のようす
6 3 中和反応 おのれー Note

イオン Ict教材eboard イーボード

アンモニアと塩化水素の中和反応 化学がちょっとだけ好きな社労士

ボルタ電池を作る時 塩酸はなぜ電離してるんですか Clear
高校化学の塩酸の生成方法で Hclは強酸で電離度が高いのに どうして図のhイオ Yahoo 知恵袋
Http Www City Tomakomai Hokkaido Jp Files Pdf

Excel イオン式 電離式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ

中3化学 塩酸の電気分解 中学理科 ポイントまとめと整理
塩酸の電解

イオン式 電離式まとめ 中学理科 ポイントまとめと整理
中3理科 塩酸の電気分解のポイント Examee

2 2 3 電離平衡
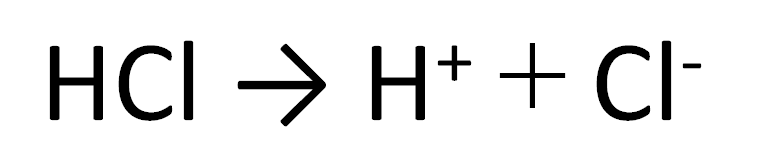
イオンで考えてみよう 酸と塩基の中和 ふかラボ

理論 3 受験 定期テストで高校化学を完全攻略
電気分解 印刷用まとめ

水素イオン濃度 他段階電離 2段目の電離の変化量は何故 Ca2になるのでしょうか 化学に関する質問 勉強質問サイト

電離 塾の質問箱
6 1 酸と塩基 おのれー Note
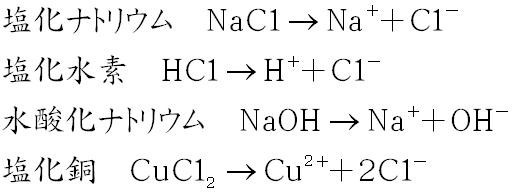
Science イオン 働きアリ

中3 水溶液とイオン 中学生 理科のノート Clear
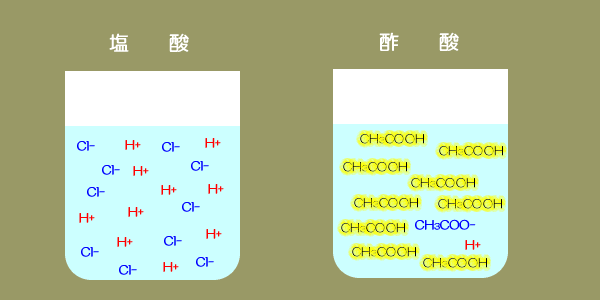
この図は うすい塩酸の電気分解を模式的に表したもので a Bは塩化水素が電離 Yahoo 知恵袋

電解質と非電解質の違い 水に溶けてイオンになる物質 ならない物質 図解でわかる危険物取扱者講座
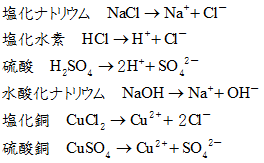
Science 超速まとめ 水溶液とイオン 働きアリ
塩化水素の電離ですが H Cl にはならないのですか またなぜですか Yahoo 知恵袋
中3理科 酸とアルカリの実験のポイント Examee
Http Www Ed2 City Yamato Kanagawa Jp C Hiki Index Cfm 1 818 C Html 818 0522 Pdf
高校入試の理科に出やすい問題 化学式編 個別指導学習塾開成館アカデミー桂川
酸と塩基 定義 価数 分類 液性 中和反応 中和滴定などについて解説

中3 イオンについてです Clear
中3理科 酸とアルカリ Pikuu

電離平衡と電離定数 電離度と水素イオン濃度の関係

理科とか苦手で 水溶液とイオン08 原子の成り立ちとイオン 8 電離
中3理科 塩酸の電気分解のポイント Examee
塩酸の電離と電離式まとめ 中3理科 理科デジノート

86 の式に塩化水素を加えると右側に平衡移動するらしいので 化学に関する質問 勉強質問サイト

1ℓで電離度を考える というのは分かります 電離度の求め方も 化学に関する質問 勉強質問サイト
中3理科 酸 アルカリと中和 要点まとめノート 中学生勉強サイトあかね先生
電解質と非電解質

揮発性酸遊離反応とは 塩化水素や硝酸の製法である理由とは 化学受験テクニック塾
Http Www2 Kobe C Ed Jp Smy Ms Action Common Download Main Upload Id

6 1 酸と塩基 おのれー Note

中和 Ict教材eboard イーボード
E Clus Com Cgibin Io Upload File Course 2 2aedb79cd1a7fb Pdf

中3理科 電解質の電離 陽イオンと陰イオンのでき方 Pikuu

緊急 Clear

アンモニア Nh3 の電離式を教えてください Clear

2 2 3 電離平衡
電離平衡

塩化水素の電離 Youtube
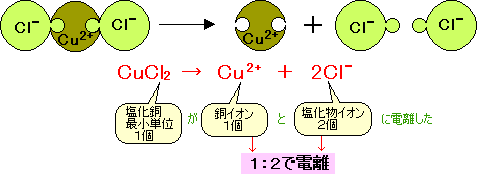
塩化銅の電解




